Anexos
1)Factores que determinaron el éxito de las experiencias de Mendel.
1.1)La selección de las plantas utilizadas.
Ejemplo: la ardeja, tiene un cultivo sencillo y un crecimiento a corto tiempo.
1.2) el registro de datos de cada experiencia fue minucioso y preciso: esto permitió registrar el tipo de descendientes en cada generación y llegar a conclusiones validas hasta hoy.
1.3) selección de caracteres sencillos: se tomó uno o dos de los caracteres para mejor presición.
1.4) el empleo de las matemáticas: especialmente en las probabilidades y el análisis combinatorio, para analizar sus observaciones y formular una hipótesis explicatorio de cada experiencia.
2)¿Cómo se da la herencia del sexo?
Lo determina un para de cromosomas sexuales que son diferentes en el hombre y en la mujer.
En el hombre son 46 cromosomas. 44 son conocidos como autosomas, los cuales se distribuyen en 22 pares, los 2 restantes son conocidos como cromosomas sexuales, por ser los que determinan el sexo.
En la mujer son iguales y se les conoce como XX y en el varón son distintos a un cromosoma se le conoce como X y al otro como Y.
Al formarse los gametos los 2 cromosomas se dividen, de tal manera que la mitad de los espermatozoides llevan el cromosoma X y la otro mitad el cromosoma Y, en cambio, los óvulos llevan un cromosoma X.
La fecundación se realiza al asar, puede efectuar el del espermatozoide de uno de los 2 tipos.
Cuando se tiene descendientes, las probabilidades de que se procree varón o mujer son iguales, por consiguiente, el ser varón o mujer es un simple azar.
3)Herencia del factor RH en la sangre:
Un individuo se considera que este RH (+) se presenta un componente llamado aglutinogeno y lo contrario es RH (-)
Por estudios científicos se ha comprobado que la rasa de color negro son 100% RH (+), mientras que en la población blanca el 85% es RH (+) y el 15% es RH (-)
Es muy importante saber que el factor RH (+) es siempre dominante y el RH (-) es recesibo. (Averiguar tipos de sangre)
- PROBLEMAS GENETICOS HUMANOS:
4.1- Caracteres patológicos ligados al cromosoma X.
El cromosoma X puede ser también portador de algunos genes que van a orientar caracteres patológicos hereditarios en el nuevo individuo, como la hemofilia, el daltonismo, la miopía y el astigmatismo.
4.1.1-
4.1.2- EL DALTONISMO: consiste en confundir los colores especialmente el rojo con el verde y viceversa.
4.1.3- Investigar miopía y astigmatismo.
Una persona con miopía tiene dificultades para enfocar bien los objetos distantes, lo que puede conducir también a dolores de cabeza, bizqueo y tensión en los ojos.
En el astigmatismo, la magnitud del error de enfoque es diferente según el eje del meridiano de fijación, esto hace que los objetos se vean distorsionados.
El astigmatismo es de origen hereditario, pero también se puede producir por culpa de complicaciones en intervenciones quirúrgicas, traumatismos o enfermedades.
5)Herencia de los rasgos físicos:
Rasgos | Dominante | Recesivo |
Color de pelo | negro | Rubio |
Cabello | Risado | Liso |
Mechon Blanco frontal | Si | No |
Color de los ojos | Negro | Azul |
Color de la piel | Barios genes determinan el color | Albino |
Astigmatismo | Padece | Visión normal |
Pabellón de la oreja | Desprendido | Adherido |
Labios | Gruesos | Finos |
Desarrollo del sabor | Catadores | No catadores |
Enrollamiento de la lengua | Si puede | No puede |
Grupo sanguineo | A-B AB | 0 |
Química Orgánica
1.1 Definición.
- Es la rama de la química que estudia una clases de moléculas que contienen carbono y sus compuestos, formando enlaces covalentes, a vez incluye, también, los compuestos sintéticos.
1.2. Importancia.
Es importante porque estudia la base principal de todos los compuestos orgánicos, el carbono: el carbono esta presente en nuestra vida, en la ropa en jabones, en grasas, proteínas, azucares, etc.
También los componentes orgánicos están presentes en la vida diaria de nuestra vida, como, la ropa que vestimos, los útiles de aseo personal, medicinas y hasta en la comida.
2. Estudio del átomo de carbono.
El carbono tiene 4 electrones de valencia capa mas externa, estas se pueden parearse con otros átomos para así obtener enlaces covalentes nitrógeno, hidrogeno y oxigeno.
Pero su papel mas importante que realiza es la capacidad de compartir pares de electrones con otros átomos de carbono para formar enlaces covalentes carbono-carbono.
2.1. Propiedades físicas.
El carbono existe en dos maneras Alotrópicas:
- El grafito: es la forma más estable del carbono, es blando de color gris. Es un conductor de la electricidad, es un buen lubricante y posee brillo metálico.
Se utiliza como electrodos inertes en pilas o celdas galvánicas.
- El diamante: es un mal conductor de la electricidad.
Se emplea para cortar metales, también ahí diamantes transparentes que se utilizan como piedras preciosas que alcanzan un gran valor monetario.
2.2. Propiedades químicas:
2.2.1. Explicación y gráficos de cada uno.
- La covalencia: esta propiedad consiste que 4 orbitales híbridos son de igual intensidad de energía, por lo tanto sus 4 enlaces de carbono son iguales.
 | |
El Carbono forma 4 enlaces |
- La tetravalencia: es cuando el carbono se manifiesta siempre como tetravalente y sus enlaces son covalentes e iguales entre si.

- La hibridación: Es la función de diferentes orbitales de energías del mismo nivel pero de subnivel distinto, resultando orbitales de energía constante y de igual forma.

-La autosaturación: Esta propiedad se define como la capacidad del átomo de carbono para compartir sus electrones de valencia consigo mismo, formando cadenas carbonadas. Al compartir sus electrones con otros átomos de carbono puede originar enlaces simples, dobles, o triples.
| |
Etano- un enlace carbono-carbono |
3. Enlaces químicos
Es la unión entre dos o más átomos para formar otra entidad molécula, para que esto se realice se deben utilizar la regla de dueto y la regla del octeto.
Regla del dueto, es la regla que cumple el hidrógeno al compartir átomos con otros elementos y así poder completar su orbital del mínimo subnivel.
Ley del Octeto, establece que el nivel electrónico se completa con 8 electrones, excepto el Hidrógeno, que se completa con 2 electrones.
3.1 Tipos de enlace:
3.1.1. Iónico: Es la unión que se produce entre dos átomos de electronegatividades distintas.
3.1.2. Covalente: Se forma entre átomos de elementos que tienen naturaleza semejante, de manera que no pierden ni ganan electrones si no que los comparte.
3.1.3. Covalente sencillo: Es cuando se comparte un par de electrones entre los átomos que forman el enlace, en otras palabras cada átomo aporta un electrón.
3.1.4 Enlace metálico: los átomos se agrupan de forma muy cercana unos a otros, lo que produce estructuras muy compactas. Se trata de redes tridimensionales que adquieren la estructura típica de empaquetamiento. En este tipo de estructura cada átomo metálico está rodeado por otros doce átomos (seis en el mismo plano, tres por encima y tres por debajo).
1. Configuración electrónica:
Es el modo en el cual los electrones están ordenados en un átomo. La configuración electrónica del átomo de un elemento corresponde a la ubicación de los electrones en los orbitales de los diferentes niveles de energía. Los electrones están sujetos al principio de exclusión de Pauli, que dice que los electrones no pueden estar en el mismo estado cuántico a la vez, por lo que, un electrón al ocupar un estado cuántico, el otro electrón debe ocupar otro estado diferente.
Valores de números cuánticos.
Letra | S | P | D | F | G |
Máximo número de electrones | 2 | 6 | 10 | 14 | 18 |
Distribución Electrónica
Es la distribución de los electrones en los subniveles y orbitales de un átomo. 1s2 2s2 2p3 Configuración electrónica de los elementos.
Un subnivel s puede acomodarse 1 o 2 electrones . El subnivel p, puede acomodarse
2. Tabla periódica:
| Grupo | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |
| I | II | III | IV | V | VI | VII | VIII | ||||||||||||
| Periodo | |||||||||||||||||||
| 1 | 1 H | 2 He | |||||||||||||||||
| 2 | 3 Li | 4 Be | 5 B | 6 C | 7 N | 8 O | 9 F | 10 Ne | |||||||||||
| 3 | 11 Na | 12 Mg | 13 Al | 14 Si | 15 P | 16 S | 17 Cl | 18 Ar | |||||||||||
| 4 | 19 K | 20 Ca | 21 Sc | 22 Ti | 23 V | 24 Cr | 25 Mn | 26 Fe | 27 Co | 28 Ni | 29 Cu | 30 Zn | 31 Ga | 32 Ge | 33 As | 34 Se | 35 Br | 36 Kr | |
| 5 | 37 Rb | 38 Sr | 39 Y | 40 Zr | 41 Nb | 42 Mo | 43 Tc | 44 Ru | 45 Rh | 46 Pd | 47 Ag | 48 Cd | 49 In | 50 Sn | 51 Sb | 52 Te | 53 I | 54 Xe | |
| 6 | 55 Cs | 56 Ba | * | 71 Lu | 72 Hf | 73 Ta | 74 W | 75 Re | 76 Os | 77 Ir | 78 Pt | 79 Au | 80 Hg | 81 Tl | 82 Pb | 83 Bi | 84 Po | 85 At | 86 Rn |
| 7 | 87 Fr | 88 Ra | ** | 103 Lr | 104 Rf | 105 Db | 106 Sg | 107 Bh | 108 Hs | 109 Mt | 110 Ds | 111 Rg | 112 Uub | 113 Uut | 114 Uuq | 115 Uup | 116 Uuh | 117 Uus | 118 Uuo |
| Lantánidos | * | 57 La | 58 Ce | 59 Pr | 60 Nd | 61 Pm | 62 Sm | 63 Eu | 64 Gd | 65 Tb | 66 Dy | 67 Ho | 68 Er | 69 Tm | 70 Yb | ||
| Actínidos | ** | 89 Ac | 90 Th | 91 Pa | 92 U | 93 Np | 94 Pu | 95 Am | 96 Cm | 97 Bk | 98 Cf | 99 Es | 100 Fm | 101 Md | 102 No |
Tabla periódica de los niveles primarios de energía
|
| ||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
| ||||||||||||||||||||||||||||
|
|
|
|
|
|
|
| ||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ||||||||||||||||||
|
| ||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
| ||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| s | s | ||||||||||||||||
| s | s | p | p | p | p | p | p | ||||||||||
| s | s | p | p | p | p | p | p | ||||||||||
| s | s | d | d | d | d | d | d | d | d | d | d | p | p | p | p | p | p |
| s | s | d | d | d | d | d | d | d | d | d | d | p | p | p | p | p | p |
| s | s | d | d | d | d | d | d | d | d | d | d | p | p | p | p | p | p |
| s | s | ||||||||||||||||
| f | f | f | f | f | f | f | f | f | f | f | f | f | f | ||||
| f | f | f | f | f | f | f | f | f | f | f | f | f | f |
3. Funciones Químicas
3.1 Definición:
Son el conjunto de compuestos que tiene propiedades comunes por la presencia de elementos similares.
3.2 Principales F. químicas:
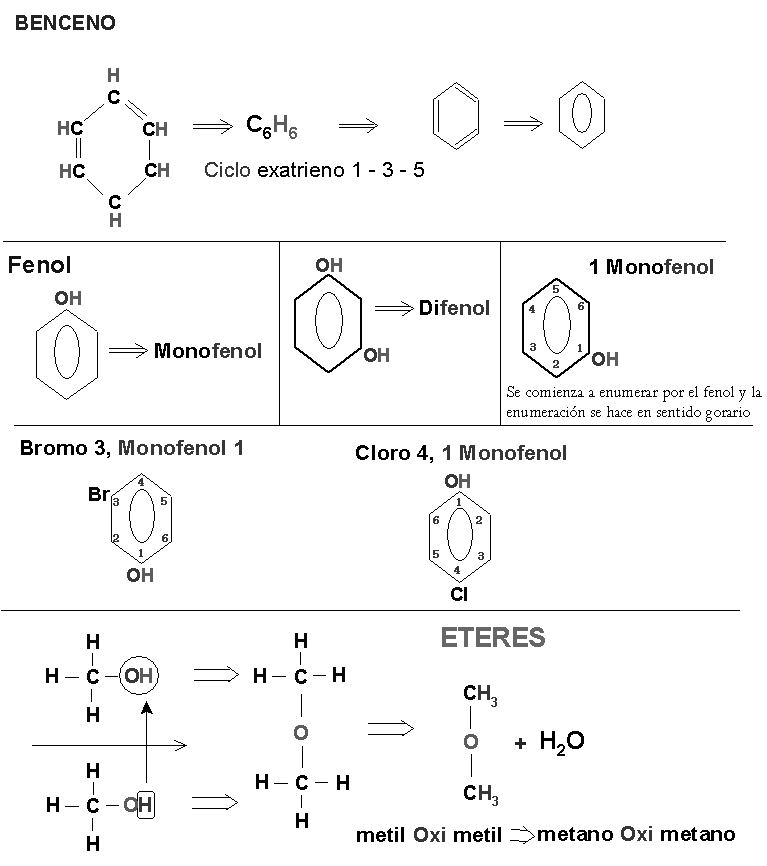
Hidrocarburos:
Compuestos formados por hidrógeno y carbono.
El tipo de enlace covalente:
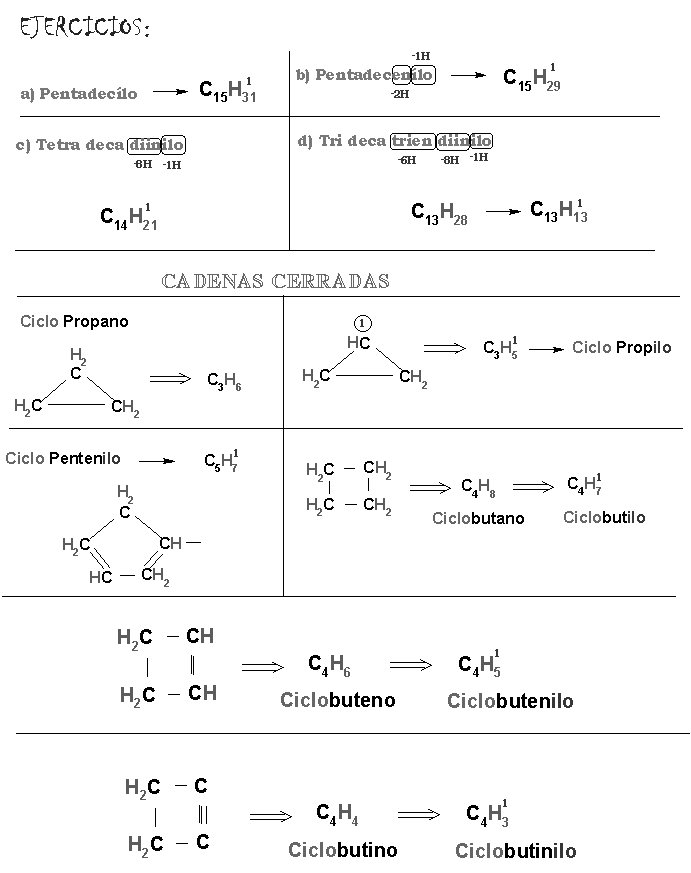
- Alcanos : son los hidrocarburos cuyos átomos de carbono están unidos por enlaces simples.
(-) CnH (2n + 2)
- Alquenos: son los hidrocarburos cuyos átomos presentan uno o más enlaces dobles.
(=) CnH (2n)
- Alquinos: son los hidrocarburos cuyos átomos presentan uno o más enlaces triples.
( = + - ) CnH ( 2n – 2)
Prefijo | Sufijo |
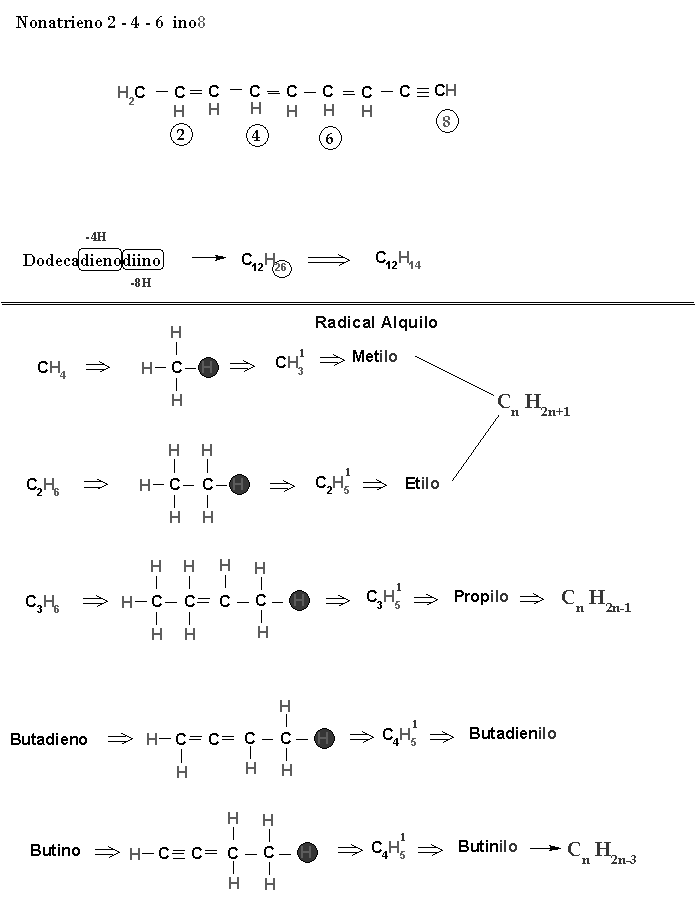
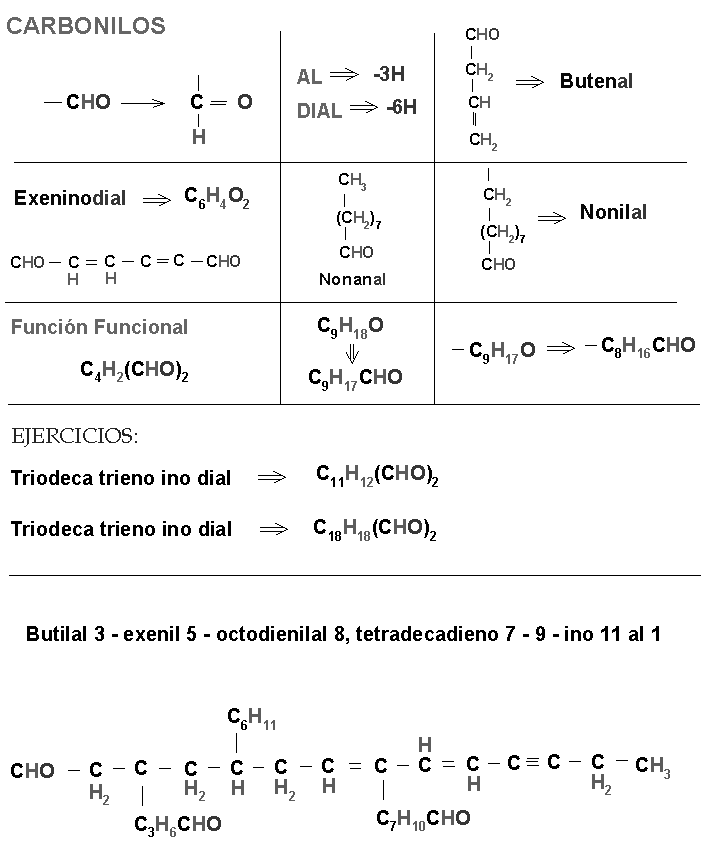
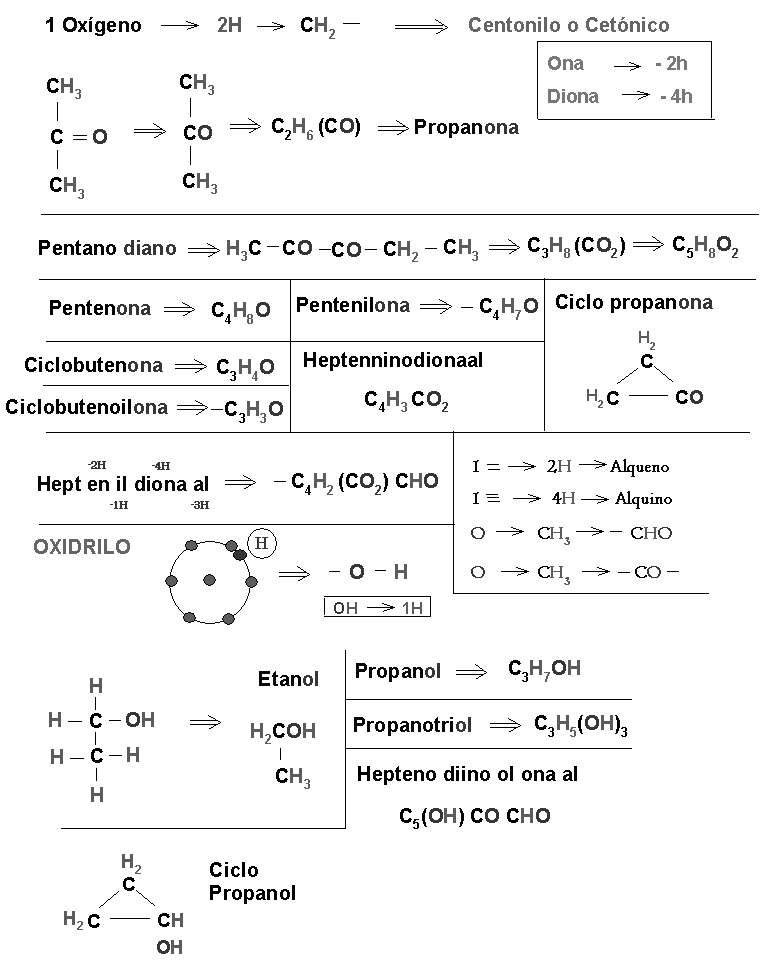
Met:1 Et:2 Prop:3 But:4 Pent:5 Ex:6 Pet:7 Oct:8 Non:9 Dec:10 Undec:11 Dodeca:12 Trideca:13 Tetradeca:14 … Eicos:20 | di y tri: ano, eno e ino |
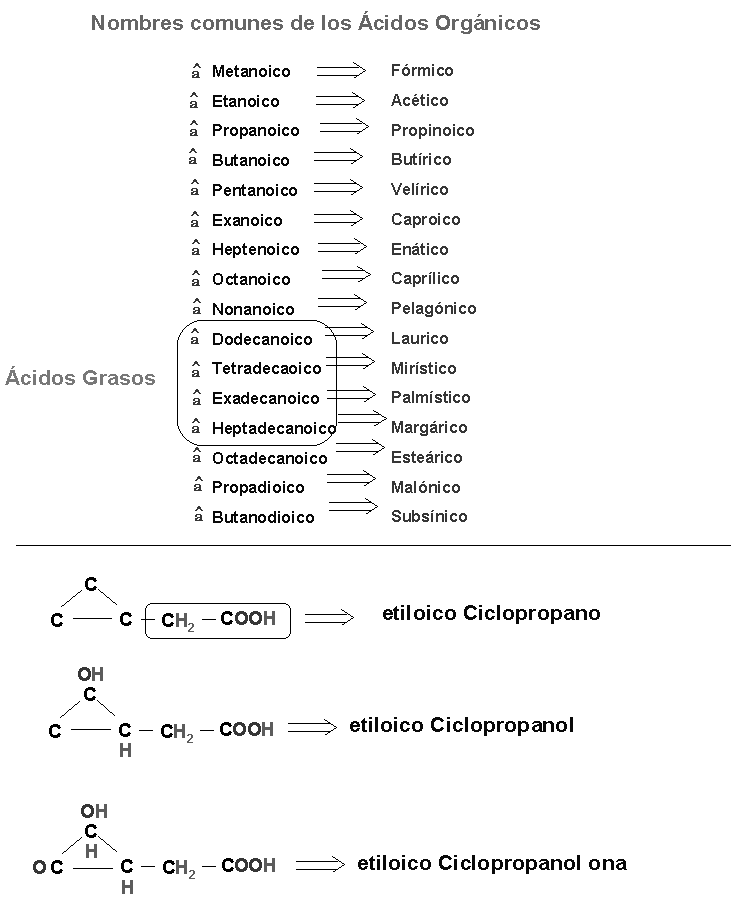
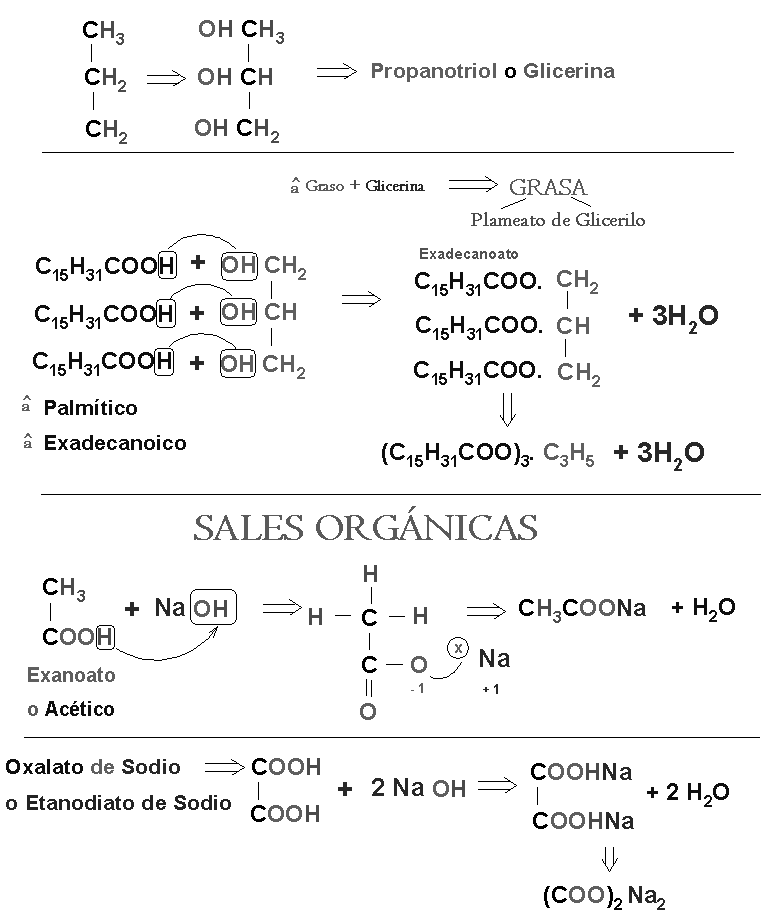
a) Oxigeno; alcohol, aldehídos, cetonas, éteres, ácidos orgánico.
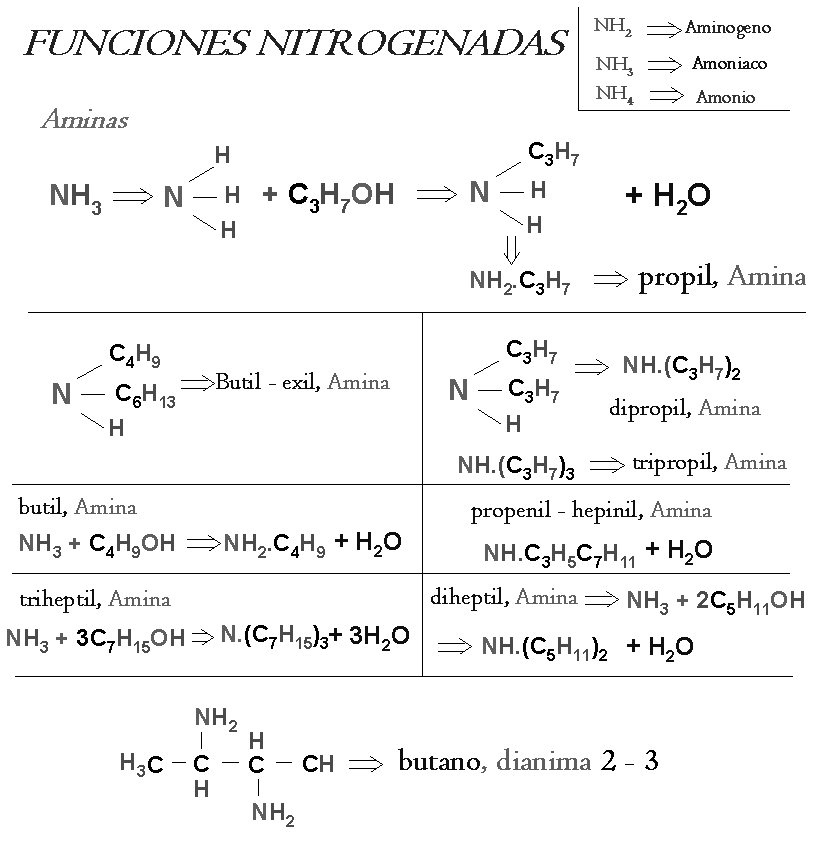
b) Nitrógeno; aminas, iminas, cianuros, aminoácidos, nutrilos.
- Cadenas Carbonadas:
1.1. Por tipo de enlace:
1.1.1. Cadenas Carbonadas Saturadas; cuyos átomos están unidos por solo enlaces químicos simples.
![]()
1.1.2. Cadenas Carbonadas No saturadas; unidas por enlaces dobles simples o triples.
![]()
- Forma de Cadena:
1.1. Cadena Abierta.
1.1.1. Cadena Lineal; tiene inicio y final (2 extremos).
![]()
1.1.2. Cadena Ramificada; varios extremos.

1.2. Cadena Cerrada o ciclica: forman figuras geométricas.

.
.
.

.
.
.
Fórmulas para expresar una cadena carbonada:
-Fórmula desarrollada o estructurada: da la ubicación en el espacio de los átomos que componen la cadena.
- Fórmula semidesarrollada: indica el tipo de enlace que hay entre los átomos que conforman la cadena y a la vez el número de hidrógenos que le corresponden a cada átomo de carbono.
- Fórmula Global, general o empírica: indica el número de átomos de cada elemento que conforman la molécula.

1.2. Carbono Secundario: se une a un carbono por enlace doble y cuando se une a 2 carbonos por enlaces simples; tiene 2 hidrógenos.
1.3. Carbono Terciario: átomo de carbono que comparte electrones con otro átomo de carbono por un enlace triple; átomo de carbono que comparte electrones con dos átomos de carbono por un enlace simple y uno doble. Tiene un hidrógeno.
1.4. Carbono Cuaternario: cuando se une a un carbono por enlace cuádruplo, cuando se une a 2 carbonos por enlace simple y triple, cuando se une por 2 enlaces dobles, no tiene hidrogeno.

Para nombrar una cadena carbonada lineal, primero se debe observar si posee algún enlace doble o triple, si sólo posee enlaces simples, se puede empezar a numerar desde cualquier extremo:

Está cadena se nombraría de la siguiente manera: Butano, porque tiene 4 átomos de carbono but, y comparten electrones por enlaces simples alcano.
Si tuviese un único enlace doble o enlace triple, se empieza a numerar por el extremo más cercano al enlace doble o triple, y se númera el átomo en el que se inicia el enlace doble o triple.










No hay comentarios:
Publicar un comentario